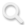细菌感染相关的组织损伤与器官衰竭,并非由活菌直接导致。近年研究发现,细菌释放的膜囊泡(MVs)作为“毒力因子载体”,可在无活菌存在的情况下,直接攻击宿主细胞并诱发过度炎症,成为感染恶化的重要推手。尤其在耐药菌感染日益严峻的背景下,针对细菌膜囊泡的干预手段仍十分有限,亟需探索新的“非杀菌”抗感染路径。
近日,复旦大学附属中山医院重症医学科冒海蕾研究员团队联合苏州大学严锋教授及上海交通大学医学院附属第九人民医院王斌教授团队在国际知名期刊《Advanced Materials》(先进材料,IF:26.8)在线发表题为“Poly(Ionic Liquid) Nanofibers Suppress S. aureus Membrane Vesicle-Induced NETosis to Mitigate Wound and Lung Damage”(聚离子液体纳米纤维抑制金葡菌膜囊泡诱导的NETosis并缓解伤口感染与肺损伤)的研究论文。
该研究首次系统揭示了金葡菌膜囊泡在驱动中性粒细胞过度活化、形成胞外诱捕网(NETs)并导致组织屏障破坏中的核心作用,并创新性地提出一种基于聚离子液体纳米纤维的“非杀菌”抗感染策略,通过靶向清除膜囊泡,从上游阻断炎症失控,显著改善感染预后。
研究发现,金葡菌释放的膜囊泡可携带脂磷壁酸及多种毒力因子,即使在无活菌存在的情况下,仍可强烈诱导中性粒细胞过度激活并形成胞外诱捕网(NETs),进而破坏血管内皮屏障,引发渗出性炎症、组织坏死及器官损伤。在动物模型中,单独给予膜囊泡即可造成严重感染性伤口损伤,并在系统感染模型中引发严重肺损伤,24小时内死亡率高达80%。进一步研究表明,单纯通过DNase I降解已形成的NETs,难以有效改善组织损伤和生存结局,提示必须在上游直接干预膜囊泡。
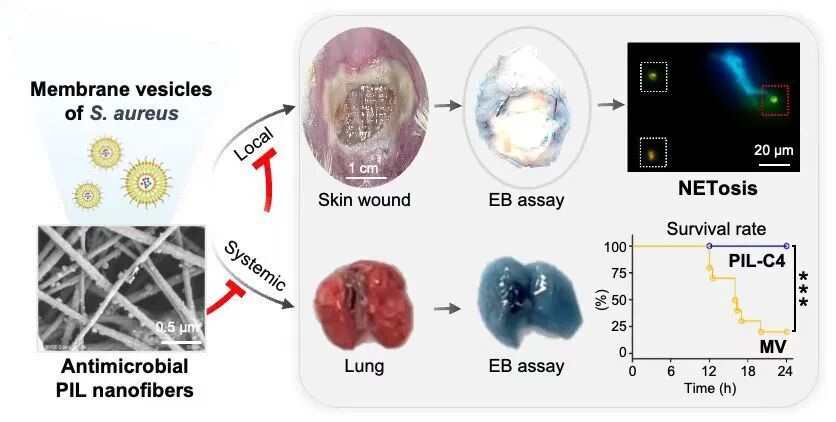
为了实现对膜囊泡的精准清除,研究团队结合分子动力学模拟,比较了不同结构聚离子液体与膜囊泡之间的相互作用,筛选出短链咪唑型聚离子液体(PIL-C4)。该材料可通过强静电吸附与疏水插入协同作用,高效捕获膜囊泡及其毒力成分。基于PIL-C4构建的电纺纳米纤维膜在体内外实验中展现出优异性能:不仅能够高效清除金葡菌膜囊泡,还可同步吸附多种毒力蛋白,有效阻断细菌耐药性的传播,并保持良好的血液与细胞相容性。在感染性伤口模型中,该材料显著减轻局部炎症反应并促进组织修复;在系统感染的肺损伤模型中,则有效抑制过度NETosis(NETs异常形成),维持血管屏障稳态,并显著提高生存率。
该研究提出了一种不同于传统抗生素和杀菌材料的全新抗感染范式——通过清除“致病信息载体”而非直接杀灭细菌,实现对炎症失控的上游调控。这一“绿色抗菌”策略为感染性相关炎症损伤的理解及重症感染干预提供了新视角。相关技术已申请发明专利,具备良好的临床转化前景。
该研究由硕士研究生林佳颖、段佳利为共同第一作者,通讯作者为冒海蕾研究员(复旦大学附属中山医院)、严锋教授(苏州大学)及王斌教授(上海交通大学医学院附属第九人民医院)。