
在同济大学附属同济医院普通外科主任胡志前教授指导下,李新星副主任医师团队联合同济大学生命科学与技术学院徐艳萍教授团队,近期在消化道肿瘤研究领域取得系列重要进展,连续在国际权威期刊Clinical and Translational Medicine(《临床与转化医学》)与Cell Death & Disease(《细胞死亡与疾病》)发表高水平学术论文,揭示了胃癌与肝细胞癌(HCC)发生发展的关键分子机制,为相关肿瘤靶向治疗策略提供了新的理论依据和研究思路。
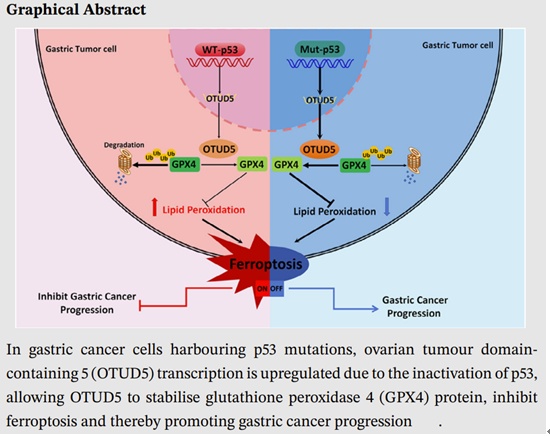
2025年3月,团队在Clinical and Translational Medicine(影响因子8.1,Q1)发表题为《p53 inhibits OTUD5 transcription to promote GPX4 degradation and induce ferroptosis in gastric cancer》(PMID: 40070026)的研究论文,系统阐明了p53-OTUD5-GPX4轴在胃癌铁死亡调控中的核心作用。研究发现,OTUD5作为GPX4的去泛素化酶,能够稳定GPX4蛋白,抑制铁死亡,促进胃癌细胞生存。而野生型p53通过抑制OTUD5转录,从而促进GPX4降解、诱导铁死亡,有效抑制肿瘤进展。突变型或缺失的p53失去该调控能力,导致OTUD5上调,铁死亡敏感性降低,促进胃癌发生发展。研究结果不仅揭示了p53失活驱动胃癌的新机制,也提示OTUD5是未来可靶向的新治疗窗口。

胡志前主任表示:“团队近期在消化道肿瘤方向取得的一系列原创性成果,体现了我科坚持临床需求驱动基础研究、推动成果转化的学术方向。我们在Molecular Cancer(影响因子27.7)也刚刚修回了一篇论文,针对MSS型大肠癌免疫治疗耐药这一国际难题,首次提出通过去泛素化酶联合免疫增敏的新型治疗策略,这一创新措施具有重要的临床转化意义和应用前景。未来,我们将进一步加强机制研究,推动研究成果向精准医疗和个体化治疗转化,切实造福更多消化道肿瘤患者。”
近年来,在胡志前教授指导下,同济医院普通外科团队围绕胃癌、结直肠癌、肝癌等消化道肿瘤,持续加强多学科交叉合作,已在Advanced Materials、Cancer Communications、Small methods、Nature Communication、EMBO Molecular Medicine等国际高水平期刊发表多篇高影响力论文,推动科室科研水平和国际学术影响力不断提升。

普通外科
副主任医师
专家门诊:周三上午
上海市抗癌协会胃肠微创外科专业组委员、上海市中西医结合学会外科专业组委员兼青委会副主任委员、上海市中西医结合学会围手术期专业组青年委员、世界内镜医师协会消化内镜协会青年委员等学术任职,担任American Journal of Translational Medicine、Medicine in Microecology、中国肿瘤生物治疗杂志、肝胆胰外科杂志等审稿人
网上预约挂号

图文|普通外科
责任编辑|谢壮丽